16 Şubat Cuma günü FDA'da, agresif ve ilerlemiş tümörlerin çoğunun tedavi şeklini değiştirebilecek yeni bir kanser terapisini onaylandı. Iovance Biotherapeutics şirketinin Amtagvi adı verilen tedavi yönetimi, diğer ilaçları denemiş ve başarısız olmuş cilt kanseri hastalarına umut olabilecek. Bu yöntem TIL tedavisi olarak da biliyor ve tümörlerin içindeki bağışıklık hücrelerinin sayısını artırarak kanserle savaşma güçlerinden yararlanmayı hedefliyor.
DÜNYADA BİR İLK

Bu yöntemle katı tümörleri tedavi etmek için ilk kez bir hücresel terapi onaylandı. İlaca, faz 2 klinik deneyinin sonuçlarına dayanarak hızlı bir onay verildi. Şirket, tedavinin faydalarını doğrulamak için daha büyük bir 3. aşama denemesi yürütmeye başladı. Terapinin liste fiyatı (sigorta ve diğer olası indirimlerden önceki fiyat) hasta başına 515.000 dolar.

Boston'daki Dana-Farber Kanser Enstitüsü'nden kıdemli doktor Dr. Elizabeth Buchbinder, ilacın etkisi için "Bu çok büyük olacak" dedi. Cilt kanserinin "20'ye yakın farklı tedavinin olduğu kanserlerden biri olmadığını" belirterek, “Seçenekleriniz hızla tükenmeye başlıyor" ifadelerini kullandı.
TEDAVİ YÖNTEMİ NASIL?

TIL, tümörlerin içinde bulunan bağışıklık hücreleri olan, tümöre infiltre eden lenfositleri ifade eder. Ancak hiçbir yerde bu hücrelerin kanser hücrelerine karşı etkili bir şekilde savaşmaya yetecek kadar sayısı yoktur. TIL tedavisi, kısmen bu bağışıklık hücrelerinin bir kısmının hastanın tümöründen çıkarılmasını ve bunların laboratuvarda milyarlarca kez kopyalanmasını, ardından bunların hastaya geri verilmesini içerir.
SAYILARININ ARTIRILMASI

Bu, sağlıklı hücrelerin kişinin vücudundan alındığı ve daha sonra kanserle savaşmak üzere laboratuvarda değiştirildiği CAR-T hücre terapisine benzer. Bu genellikle lösemi ve lenfoma gibi tedavisi zor kan kanserleri için kullanılır. TIL terapisinde, kullanılan hücreler zaten kanseri tanıyacak şekilde programlanmıştır; laboratuvarda değişiklik yapılmasına gerek yoktur; yalnızca kanserle savaşmak için sayılarının artırılması gerekir.
TEDAVİ SÜRESİ 8 HAFTA CAR-T

gibi TIL tedavisi de tek seferlik bir tedavidir, ancak tüm süreç sekiz haftaya kadar sürebilir. Iovance'a göre TIL hücreleri ilk olarak tümörden minimal invaziv bir prosedürle toplanıyor ve ardından laboratuvarda büyütülüp çoğaltılıyor; bu süreç 22 gün sürüyor.
KEMOTERAPİ UYGULANIYOR
Bu gerçekleşirken hastalara, melanomla savaşan milyarlarca yeni TIL hücresine yer açmak amacıyla bağışıklık hücrelerini temizlemek için kemoterapi veriliyor. TIL hücreleri tekrar vücuda enjekte edildiğinde, hastalara bu hücreleri daha fazla uyarmak için interlökin-2 adı verilen bir ilaç veriliyor.
YAN ETKİLERİ VAR
Hwu, TIL tedavisi gören hastalardaki yan etkilerin çoğunun hücrelerin yeniden infüzyonundan değil, kemoterapi ve interlökin-2'den kaynaklandığını söyledi. Bunlar mide bulantısı ve aşırı yorgunluğu içerebilir ve vücut hastalıklarla savaşan beyaz kan hücrelerinden yoksun olduğundan hastalar diğer hastalıklara karşı da savunmasızdır.
RİSKİ VAR MI?
Ancak Amerikan Kanser Derneği'nin baş bilim sorumlusu Dr. William Dahut, milyarlarca hücreyi vücuda geri yerleştirmenin tamamen risksiz olmadığını söyledi. Vücudun bağışıklık sisteminin, sitokin fırtınası olarak bilinen, grip benzeri semptomlara, düşük tansiyona ve organ hasarına neden olabilecek aşırı tepki vermesi mümkündür. "Bağışıklık sistemiyle ilişkili yan etkiler açısından ciddi olabilecek riskler var" dedi. FDA, Amtagvi ile ilişkili yaygın yan etkilerin anormal derecede hızlı kalp atış hızı, sıvı birikmesi, döküntü, saç dökülmesi ve nefes darlığı hissini içerebileceğini söyledi.
YAN ETKİLER KONTROL ALTINA ALINABİLİR Mİ?
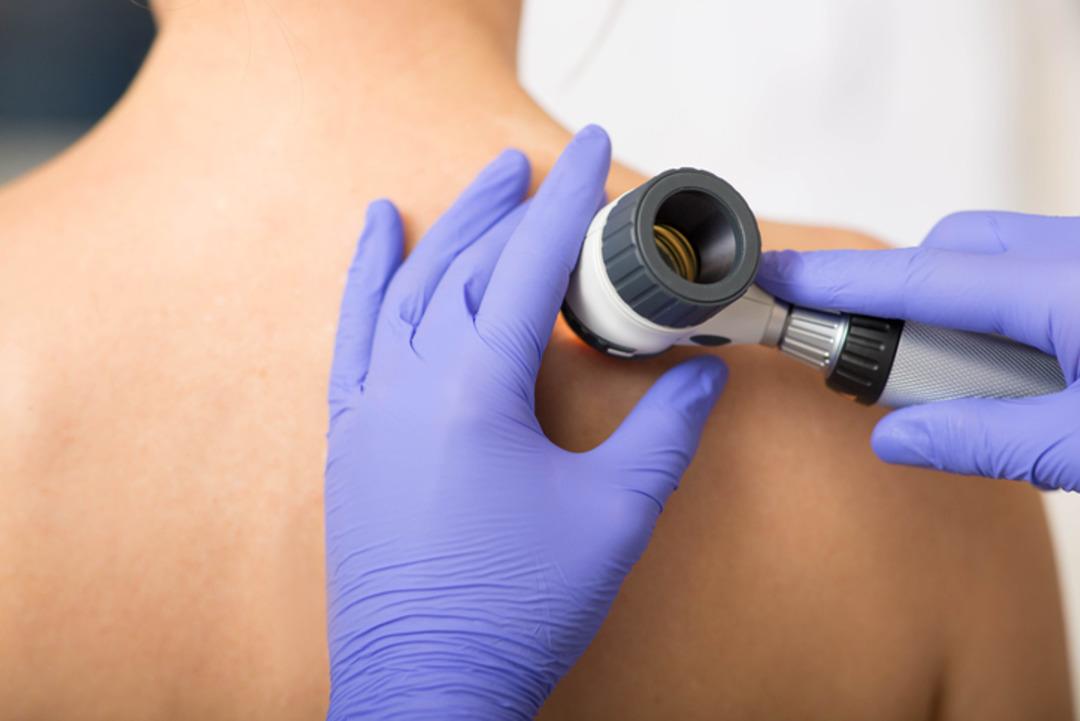
Ulusal Kanser Enstitüsü cerrahi bölümü başkanı Dr. Steven Rosenberg, bu yan etkilerin kontrol altına alınabileceğini söyledi. "Bunlar, aksi halde ölümcül olabilecek, büyüyen bir kanser için ödenecek küçük bir bedel." ifadelerini kullandı. Genel olarak Dahut, TIL tedavisinin onaylanmasının "anlamlı" olduğunu söyledi. Dahut, "Bunun güzel yanı, hastalara, direncin üstesinden gelme kapasitesine sahip olacak ve aslında zaman içinde, gelişmeleri halinde ek kanser hücrelerini hedef alan canlı bir terapi olabilecek, tümörle savaşan çok çeşitli lenfositler verilecek." dedi.
Dahut, cilt kanserine ek olarak, TIL tedavisinin büyük olasılıkla kontrol noktası inhibitörleri olarak adlandırılan "bağışıklık sisteminin frenlerini kaldıran" ilaçlara yanıt veren kanserlerde yararlı olacağını söyledi . "Bunlar küçük hücreli olmayan akciğer kanseri, böbrek kanseri, belki de mesane kanseri gibi, başlangıçta bağışıklık temelli tedavilere duyarlı olduğunu bildiğimiz şeyler olabilir" dedi. "Bu hastaların birçoğu nüks ediyor, dolayısıyla farklı şekilde çalışan başka bir bağışıklık temelli tedavi, bana bunun etkili olmasının en olası yolu gibi görünüyor." Çok daha fazla araştırmaya ihtiyaç olduğu belirtilen konuyla ilgili ve TIL tedavisinin diğer kanser türleri için de onaylanmasının yıllar alabileceği vurgulandı.
BAZILARINDA TAMAMEN YOK OLDU
Iovance'ın küçük hücreli dışı akciğer kanseri için TIL tedavisini araştıran klinik deneylerinden biri, bir katılımcı öldüğünde duraklatmak zorunda kaldı. Ölüm soruşturma altındayken şirket, bunun kemoterapi ya da interlökin 2 - TIL hücrelerinin yeniden infüzyonunu almadan önce her hastanın bağışıklık sistemini çökertmeyi amaçlayan tedavilerin - sonucu olabileceğini söyledi. Terapinin her metastatik melanom hastasında işe yaraması beklenmiyor. Iovance'ın FDA'ya sunduğu klinik araştırma verileri, TIL tedavisi alan hastaların yaklaşık üçte birinde tümörlerin küçüldüğünü gösterdi. Iovance Biotherapeutics'in baş tıbbi sorumlusu Dr. Friedrich Graf Finckenstein, bu hastaların yaklaşık yarısının tümörlerinin en az bir yıl boyunca küçüldüğünü gördü. "Bu hastaların bazılarının tümörleri bile tamamen yok oldu" dedi.
YÜZDE 7'LİK FARK

Hollanda'da yürütülen başka bir çalışmada , TIL tedavisi ile ipilimumab adı verilen başka bir immünoterapi biçiminin bire bir analizi yapıldı. İpilimumab alan hastaların %7'sine kıyasla, TIL alan hastaların yüzde yirmisinde tam iyileşme görüldü.
40 YILDIR ÜZERİNDE ÇALIŞILIYOR
Teknoloji yaklaşık 40 yıldır geliştirilmekte ve üzerinde çalışılmaktadır. TIL tedavisine öncülük eden Rosenberg'di; ilk kez 1988'de New England Journal of Medicine'de cilt kanseri tümörlerini nasıl küçültebileceğini açıkladı . Rosenberg, "Bunun hastalara verildiğini görmek için çok uzun zamandır bekliyordum, çünkü bunun başka herhangi bir tedaviden etkilenmeyen metastatik melanomu olan bazı hastaları iyileştirebileceğini biliyorum" dedi. Şu ana kadar Clermont, Florida'dan 59 yaşındaki Dan Bennett için işe yaradı. Bennett'e 2011 yılında kızının boynunda renk değiştiren şüpheli bir ben fark etmesi üzerine cilt kanseri teşhisi konuldu. Ameliyata, kemoterapiye ve radyasyona rağmen kanseri nüksetmeye devam etti. 2014 yılında Moffitt'teki doktorları TIL tedavisini denemesini önerdi.
"İLK BAŞTA TEMKİNLİYDİK"
Bennett, "İlk başta bu konuda oldukça temkinliydik çünkü kanıtlanmamıştı" dedi. On yıl sonra Bennett, genellikle beş yıllık hayatta kalma oranı %22,5 olan 4. evre melanomda bu kadar uzun süre hayatta kalmasının nedeninin TIL tedavisi olduğuna ikna oldu. "Eğer son fırsatınızsa herhangi bir deneysel ilacı tavsiye ederim" dedi. “Hayatta kalmak ve toplumun üretken bir üyesi olmak için elinizden geleni yapmayı kendinize ve ailenize borçlusunuz.” Dana-Faber doktoru Buchbinder, Iovance'ın cilt kanseri için yaptığı TIL tedavisi denemesinde yer almadı, ancak diğer ilaç üreticileriyle de benzer denemelere başlaması planlanıyor. Buchbinder, "Şu anda kelimenin tam anlamıyla onay bekleyen hastalarımız var çünkü devam edebileceklerini umuyorlar" dedi. “Bu kesinlikle uygulamayı değiştiren bir terapi.”